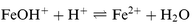Inhibition de la corrosion du fer dans HCl 1 M. Part I. Étude de l'effet inhibiteur du 2-aminothiophénol et du 2-aminophényl disulfure
K.
Benchekroun
a,
F.
Dalard
b,
J. J.
Rameau
b and
et A. El
Ghazali
c
aÉcole Normale Supérieure de Takaddoum, Rabat, Maroc
bLaboratoire d'Électrochimie et de Physico-chimie des Matériaux et des Interfaces (INPG-CNRS UMR 5631), ENSEEG, Domaine Universitaire, BP75, 38402, Saint-Martin d'Hères, France
cFaculté des Sciences, Université Mohammed V, avenue Ibn Batouta, Rabat, Maroc
First published on 8th January 2002
Abstract
L'action inhibitrice du 2-aminothiophénol (ATP) et du 2-aminophényl disulfure (APDS) sur la corrosion du fer dans HCl 1 M est étudiée par détermination de perte de masse et par analyse des courbes de polarisation potentiodynamique. Ces deux composés (ATP, APDS) réduisent la vitesse de corrosion du fer; cependant, l'APDS présente le meilleur pouvoir inhibiteur. L'effet de la concentration en inhibiteur (ATP, APDS), du temps d'immersion de l'électrode et de la température sur la vitesse de corrosion du fer sont étudiés. L'analyse des courbes de polarisation révèle que ces composés limitent la réaction de dégagement du dihydrogène sur le fer à des potentiels très cathodiques (<−0.60 V vs. ECS). La cinétique de la réaction de dissolution du fer est également diminuée plus en présence d'APDS qu'en présence de l'ATP. Néanmoins, le mécanisme des deux réactions ne semble pas être modifié.
Inhibition of iron corrosion in 1 M HCl. Part I. Study of the inhibiting effect of 2-aminothiophenol and of 2-aminophenyl disulfide.The inhibitive action of 2-aminothiophenol (ATP) and 2-aminophenyl disulfide (APDS) on iron corrosion in a 1 M HCl medium was studied by using weight loss determinations and potentiodynamic polarisation curves. Both compounds reduce the iron corrosion rate. APDS presents, however a better inhibitive power. Effect of temperature, inhibitor concentration and electrode immersion time on ATP and APDS behaviour were studied. At very cathodic potential values (less than −0.60 V), polarisation curves show that the two compounds lower hydrogen evolution on iron. ATP and APDS can also reduce the dissolution rate of iron. This effect is more pronounced with APDS. Nevertheless, the two reactions seem to follow the same mechanism as in HCl without any inhibitor.
Les composés organiques contenant des liaisons insaturées et/ou des atomes polaires comme O, N et S, sont souvent de bons inhibiteurs de la corrosion et de la piqûration du fer en milieu acide chlorhydrique.1–20 Ainsi les thiols et les amines aromatiques ont des propriétés inhibitrices et leur mode d'action a fait l'objet de plusieurs travaux.7,21–34 En particulier, le thiophénol présente un caractère d'inhibition anodique grâce à la forte densité électronique autour de l'atome du soufre.32 Cette densité électronique est stabilisée par la substitution de l'hydrogène en position ortho, par un groupement amine; la molécule ainsi obtenue (2-aminothiophénol ou ATP), acquiert un caractère d'inhibiteur mixte.32 Toutefois, il ne faut pas négliger la possibilité d'interaction entre les électrons π du noyau aromatique et les orbitales d du métal, qui devrait apporter un effet bénéfique supplémentaire puisque l'efficacité inhibitrice de ces composés est meilleure lorsque le nombre de noyaux aromatiques augmente dans la structure moléculaire.35,36 Ainsi, les facultés inhibitrices de l'ATP ont été confirmées dans le cas de la corrosion de l'acier en milieu neutre.37 En plus de l'examen du pouvoir inhibiteur de l'ATP vis-à-vis du fer en milieu acide, il nous a semblé intéressant d'étudier également le produit résultant de la condensation de l'ATP en disulfure (2-aminophényl disulfure ou APDS). On peut espérer que ce composé ayant une surface moléculaire assez grande, il se produira un recouvrement plus important de la surface métallique. Si la capacité inhibitrice de certains disulfures a été mise en évidence,38,39 aucune étude n'a été menée avec le APDS pour le fer en milieu acide.
Le présent travail consiste à évaluer, par des mesures de perte de masse, l'efficacité inhibitrice de l'ATP et de l'APDS vis-à-vis de la corrosion du fer en milieu HCl 1 M et d'examiner, par des méthodes électrochimiques, l'influence de chacun des deux composés sur la réaction de dissolution du fer et celle de dégagement du dihydrogène.
Conditions expérimentales
Cellule électrochimique et électrodes
Les essais électrochimiques sont réalisés dans une cellule en verre Pyrex à trois compartiments, avec une contre électrode en platine et une électrode au calomel saturée (ECS) comme électrode de référence. L'électrode de travail, constituée de fer Armco, est adaptée sur un disque tournant (Radiometer-Analytical, type EDI) qui permet de réaliser une agitation constante et homogène. La vitesse de rotation est choisie égale à 1000 tr mn−1 pour tous les essais. L'échantillon ayant la forme d'une tige, présente une surface de travail plane et circulaire respectivement de 0.196 cm2 pour les essais électrochimiques et de 0.785 cm2 pour les essais de perte de masse. II est maintenu en place dans un embout cylindrique en polytétrafluoroéthylène (PTFE). Pour éviter le phénomène de fluage et assurer une bonne étanchéité, une résine durcissante à froid (Lamplan) est coulée entre la tige de fer et l'embout. Avant chaque essai, la surface de l'échantillon est polie aux papiers abrasifs au carbure de silicium de grade allant de 180 à 1000; puis rincée à l'eau désionisée, nettoyée et dégraissée dans l'acétone avec action des ultrasons et finalement séchée à l'air chaud pulsé. Les essais électrochimiques sont réalisés à la température 20![[thin space (1/6-em)]](https://www.rsc.org/images/entities/char_2009.gif) ±
±![[thin space (1/6-em)]](https://www.rsc.org/images/entities/char_2009.gif) 1
1![[thin space (1/6-em)]](https://www.rsc.org/images/entities/char_2009.gif) °C. Les essais de perte de masse sont réalisés à plusieurs températures, pour différentes concentrations de l'inhibiteur dans une cellule thermostatée à double paroi munie d'un réfrigérant condenseur.
°C. Les essais de perte de masse sont réalisés à plusieurs températures, pour différentes concentrations de l'inhibiteur dans une cellule thermostatée à double paroi munie d'un réfrigérant condenseur.
Électrolytes
La solution HCl 1 M est préparée à partir de HCl 37% (Prolabo R.P. Normapur) et d'eau désionisée sur résine (Elgastat MicroMeg). La concentration est contrôlée par titrage par KHCO3 en utilisant le méthylorange comme indicateur. Les composés organiques 2-aminothiophenol (ATP) et 2-aminophényl disulfure (APDS), utilisés comme inhibiteurs, sont de qualité Aldrich. Les solutions sont préalablement désaérées pendant 2 h puis refoulées dans la cellule par surpression d'argon. Une atmosphère d'argon est maintenue au dessus de la solution, pendant la durée d'électrolyse. Pour pouvoir mener une étude comparative fiable entre la capacité inhibitrice de l'APDS et celle de l'ATP, les solutions contenant l'ATP sont toutes préparées dans une atmosphère d'argon à l'intérieur d'une boite à gants afin d'éviter l'oxydation de l'ATP par l'oxygéne de l'air et la formation d'APDS,40,41 suivant la réaction (1): | (1) |
Mesure de la vitesse de corrosion
La vitesse moyenne de corrosion du fer (Vcorr) est évaluée à partir de la détermination de la quantité d'ions ferreux passée dans la solution HCl 1 M et traduite en perte de masse par cm2 et par heure. Le dosage est effectué par spectroscopie d'absorption atomique à l'aide d'un spectrophotomètre (Varian AA-1275) étalonné à la longueur d'onde 248.3 nm. Le volume de la solution analysée est de 50 cm3.L'efficacité inhibitrice (ε1) des composés est calculée en utilisant l'expression (2):
 | (2) |
Courbes de polarisation
Le balayage du potentiel est réalisé par un potentiostat/galvanostat EG&G (PAR 273), relié à un ordinateur PC (HP Vectra 286/12) qui permet l'acquisition des données. Les courbes de polarisation anodiques et cathodiques, quasi-stationnaires, sont tracées séparément, à partir du potentiel de corrosion. Ces courbes sont enregistrées à une vitesse de balayage de 0.1 mV s−1, après une heure d'immersion de l'électrode dans la solution. Les pentes de Tafel cathodiques (bc) et anodiques (ba) sont déterminées avec une précision de ± 5 et ± 8 mV dec−1, respectivement. Les densités de courant de corrosion sont obtenues graphiquement par l'intersection des droites de Tafel anodique et cathodique extrapolées au potentiel de corrosion, en estimant que la cinétique des réactions électrochimiques responsables de la corrosion est limitée par l'étape de transfert de charge.L'efficacité inhibitrice (ε2, peut aussi être calculée en appliquant la relation (3):
 | (3) |
Résultats et discussion
Étude par dosage des ions Fe2+ en solution
| ATP | APDS | ||||
|---|---|---|---|---|---|
| Conc./mM | V corr/mg cm−2 h−1 | Efficacité ε1 (%) | Conc./mM | V corr/mg cm−2 h−1 | Efficacité ε1 (%) |
| 0 | 0.216 | – | 0 | 0.216 | – |
| 0.05 | 0.194 | 10 | 0.05 | 0.127 | 41 |
| 0.2 | 0.155 | 28 | 0.1 | 0.107 | 50 |
| 0.5 | 0.138 | 36 | 0.2 | 0.080 | 63 |
| 2 | 0.099 | 54 | 0.5 | 0.043 | 80 |
| 10 | 0.057 | 73 | 1 | 0.020 | 91 |
| 20 | 0.061 | 72 | 5 | 0.025 | 88 |
| 30 | 0.065 | 70 | 10 | 0.022 | 90 |
 | ||
| Fig. 1 Effet de la concentration de l'ATP (○), et de l'APDS (△), sur l'efficacité inhibitrice (ε1) de la corrosion du fer dans HCl 1 M. | ||
Les inhibiteurs organiques agissent généralement par adsorption sur la surface du métal. La connaissance du type d'adsorption et la détermination des grandeurs thermodynamiques caractérisant cette adsorption aide souvent à élucider le mode d'action de ces inhibiteurs. Pour cela, la valeur du taux de recouvrement de la surface du métal par l'inhibiteur adsorbé (θ), est définie par la relation suivante:1,42
 | (4) |
Dans le cas d'une isotherme de Temkin43,44 on doit avoir:
 | (5) |
 | (6) |
La Fig. 2 représente la variation de θ en fonction de la concentration en inhibiteur (ln![[thin space (1/6-em)]](https://www.rsc.org/images/entities/char_2009.gif) C) pour chacun des deux composés, après une heure d'immersion. Dans le domaine des concentrations étudiées, cette variation est linéaire, ce qui indique que les deux composés s'adsorbent sur la surface selon le modéle de Temkin. Ce mode d'adsorption est souvent rencontré dans le cas des inhibiteurs de la corrosion des métaux en milieu acide,42,44,47–49 et notamment par Bockris et ses collaborateurs33 dans le cas particulier de l'adsorption des amines aromatiques sur le fer, en milieu HCl.
C) pour chacun des deux composés, après une heure d'immersion. Dans le domaine des concentrations étudiées, cette variation est linéaire, ce qui indique que les deux composés s'adsorbent sur la surface selon le modéle de Temkin. Ce mode d'adsorption est souvent rencontré dans le cas des inhibiteurs de la corrosion des métaux en milieu acide,42,44,47–49 et notamment par Bockris et ses collaborateurs33 dans le cas particulier de l'adsorption des amines aromatiques sur le fer, en milieu HCl.
 | ||
| Fig. 2 Isotherme d'adsorption de Temkin de l'ATP (○) et de l'APDS (△) sur le fer dans HCl 1 M. | ||
Les grandeurs thermodynamiques K et ΔGoads obtenues à partir des isothermes d'adsorption sont groupées Tableau 2. La constante d'équilibre K du APDS est nettement supérieure à celle de l'ATP. Ceci suggère que l'APDS permet un meilleur recouvrement que l'ATP, d'où sa plus grande efficacité de protection contre la corrosion. Les valeurs négatives des enthalpies libres d'adsorption (ΔGoads) indiquent une adsorption spontanée des inhibiteurs sur le fer.17,38 Cette enthalpie libre d'adsorption, plus négative dans le cas de l'APDS' indique que ce dernier est plus fortement adsorbé à la surface du métal. Cette différence de comportement pourrait être due à l'encombrement stérique différent de ces inhibiteurs. Ceci confirme les études qui ont montré qu'il y a une forte adsorption et un accroissement de l'efficacité lorsque le nombre des atomes polaires et/ou des noyaux aromatiques augmente.20,35,50
| Inhibiteur | 10−4K/mol−1 | ΔGadso/kJ mol−1 |
|---|---|---|
| ATP | 4.4 | −35.7 |
| APDS | 21.1 | −40.0 |
 | ||
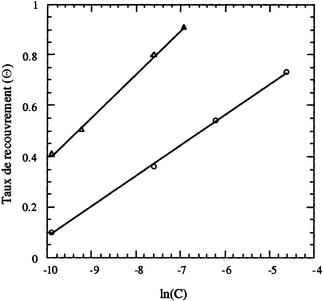
| Fig. 3 Variation de la vitesse moyenne de corrosion du fer (Vcorr) avec le temps d'immersion dans HCl 1 M pour différentes concentrations de (a) l'ATP: (○) 0, (⋄) 0.05, (△) 2, (×) 10 mM et de (b) l'APDS: (○) 0, (⋄) 0.05, (△) 0.1, (×) 0.5, (•) 1 mM. | ||
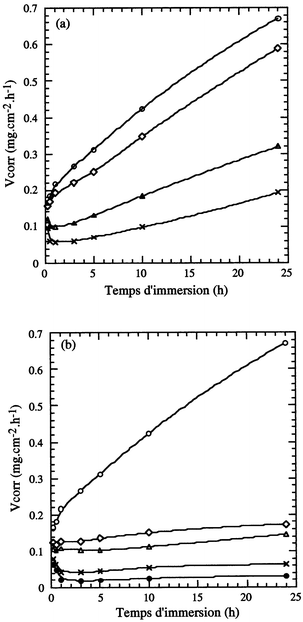
L'évolution de l'efficacité inhibitrice (ε1) avec le temps pour les deux composés ATP et APDS (Fig. 4) montre un accroissement rapide de leur efficacité, au cours des premiéres heures d'immersion. ε1 tend ensuite vers une valeur stationnaire après 5 heures d'immersion environ. A leur concentration critique (1 mM pour l'APDS et 10 mM pour l'ATP), l'APDS atteint une efficacité voisine de 96% alors que celle de l'ATP ne dépasse pas 77%.
 | ||
| Fig. 4 Variation de l'efficacité inhibitrice (ε1) avec le temps d'immersion du fer dans HCl 1 M pour différentes concentrations de (a) l'ATP: (○) 0.05, (⋄) 2, (△) 10 mM et de (b) l'APDS: (○) 0.05, (⋄) 0.1, (△) 0.5, (×) 1 mM. | ||
| Temperature/°C | ||||||
|---|---|---|---|---|---|---|
| Conc./mM | 20 | 30 | 40 | 50 | 60 | |
| V corr/mg cm−2 h−1 | ||||||
| Sans inhibiteur | 0 | 0.312 | 0.561 | 1.435 | 3.260 | 5.989 |
| ATP | 0.05 | 0.250 | 0.453 | 1.139 | 2.263 | 3.857 |
| 2 | 0.131 | 0.228 | 0.492 | 0.896 | 1.458 | |
| 10 | 0.071 | 0.122 | 0.259 | 0.400 | 0.728 | |
| APDS | 0.05 | 0.135 | 0.241 | 0.555 | 1.055 | 1.717 |
| 0.5 | 0.045 | 0.073 | 0.129 | 0.219 | 0.329 | |
| 1 | 0.020 | 0.036 | 0.054 | 0.080 | 0.117 | |
| Efficacité ε1 (%) | ||||||
| ATP | 0.05 | 19.9 | 19.3 | 20.6 | 30.6 | 35.6 |
| 2 | 58.0 | 59.4 | 65.7 | 72.5 | 75.7 | |
| 10 | 77.2 | 78.3 | 81.9 | 87.7 | 87.8 | |
| APDS | 0.05 | 56.7 | 57.0 | 61.3 | 67.6 | 71.3 |
| 0.5 | 85.6 | 87.0 | 91.0 | 93.3 | 94.5 | |
| 1 | 93.6 | 93.6 | 96.2 | 97.5 | 98.0 | |
Par ailleurs, les deux inhibiteurs étant ajoutés à leur concentration critique (10 mM pour l'ATP et 1 mM pour l'APDS), l'APDS garde toujours une meilleure efficacité que l'ATP, quelle que soit la température considérée.
Dans le cas de la corrosion du fer en milieu acide, de nombreux auteurs11,17,48–53 utilisent l'équation d'Arrhénius pour rendre compte de l'effet de la température (T) sur la vitesse de corrosion et considèrent donc que le logarithme de la vitesse de corrosion Vcorr est une fonction linéaire de T−1:
 | (7) |
La Fig. 5 représente le tracé en coordonnées d'Arrhénius de la vitesse moyenne de corrosion du fer dans HCl en l'absence et en présence de l'ATP ou de l'APDS, à différentes concentrations. Les valeurs des énergies d'activation obtenues à partir de ces droites sont données dans le Tableau 4. Dans HCl 1 M Ea vaut 62.13 kJ mol−1; cette valeur est en accord avec les données de la littérature.45,50,52,53 En présence de chacun des d'inhibiteurs dans la solution, Ea diminue lorsque que la concentration de l'inhibiteur augmente.
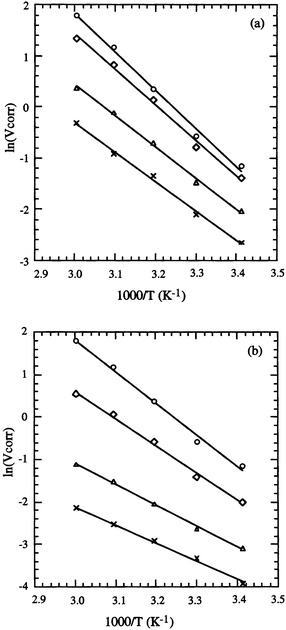 | ||
| Fig. 5 Diagramme d'Arrhénius de la vitesse moyenne de corrosion du fer dans HCl 1 M en présence de différentes concentrations de (a) l'ATP: (○) 0, (⋄) 0.05, (△) 2, (×) 10 mM et de (b) l'APDS: (○) 0, (⋄) 0.05, (△) 0.5, (×) 1 mM. | ||
| ATP | APDS | ||
|---|---|---|---|
| Conc./mM | E a/kJ mol−1 | Conc./mM | E a/kJ mol−1 |
| 0 | 62.13 | 0 | 62.13 |
| 0.05 | 57.40 | 0.05 | 53.22 |
| 2 | 50.21 | 0.5 | 41.18 |
| 10 | 47.36 | 1 | 35.36 |
On constate donc que l'énergie d'activation Ea diminue quand la concentration de l'inhibiteur devient de plus en plus grande, alors que l'efficacité ε1 augmente lorsque la température augmente. Cette particularité a déjà été rencontrée dans le cas de plusieurs autres inhibiteurs de corrosion du fer, en milieu acide;45,50,52–56 dans tous les cas, ce comportement est rapporté comme étant caractéristique d'un phénomène de chimisorption de l'inhibiteur à la surface du métal. Le taux de recouvrement, trés élevé aux températures plus élevées, suggére qu'à ces températures la vitesse de formation du film chimisorbé augmente plus vite que sa vitesse de destruction.53 Ce phénomène peut être expliqué également par le fait que le processus de corrosion du fer en présence de l'inhibiteur ne dépend pas seulement de la réaction qui a lieu à la surface du métal nu, mais aussi de la diffusion des ions Fe2+ à travers la couche d'inhibiteur adsorbé.57
A la concentration critique, lorsque le taux de recouvrement est maximal, la valeur de l'énergie d'activation en présence de l'ATP est de 47.36 kJ mol−1, alors qu'elle n'est que de 35.36 kJ mol−1 en présence de l'APDS. Ceci confirme que l'APDS participe à une chimisorption plus forte que celle de l'ATP par formation d'un film superficiel plus adhérent et donc plus efficace.
Courbes de polarisation potentiodynamique
Les valeurs du potentiel de corrosion (Ecorr) du fer dans HCl 1 M en l'absence et en présence de différentes concentrations en inhibiteur sont mesurées à l'abandon après un temps de stabilisation d'environ une heure, et sont rassemblées dans le Tableau 5. On constate qu'il y a anoblissement du potentiel de corrosion au fur et à mesure que la concentration en inhibiteur augmente. Cet effet est beaucoup plus important en présence de l'APDS qu'en présence de l'ATP.| Conc./mM | −Ecorr/mV vs. ECS | i corr/µA cm−2 | −bc/mV dec−1 | b a/mV dec−1 | Efficacité ε2 (%) | |
|---|---|---|---|---|---|---|
| Sans | 0 | 487 | 132 | 129 | 71 | – |
| inhibiteur | ||||||
| ATP | 0.05 | 473 | 120 | 139 | 67 | 09 |
| 0.2 | 463 | 91 | 150 | 66 | 31 | |
| 2 | 460 | 60 | 159 | 64 | 54 | |
| 10 | 420 | 40 | 167 | 68 | 70 | |
| 20 | 410 | 48 | 173 | 70 | 64 | |
| 30 | 407 | 52 | 178 | 69 | 60 | |
| APDS | 0.05 | 467 | 72 | 154 | 68 | 45 |
| 0.2 | 450 | 52 | 160 | 65 | 60 | |
| 0.5 | 420 | 26 | 166 | 70 | 80 | |
| 1 | 410 | 16 | 175 | 69 | 88 | |
| 5 | 390 | 20 | 194 | 67 | 85 | |
| 10 | 363 | 27 | 207 | 63 | 79 | |
Les courbes de polarisation anodique et cathodique du fer dans HCl 1 M sont tracées séparément à partir du potentiel de corrosion (Fig. 6), pour différentes concentrations en ATP et en APDS. On constate que, pour chacun des deux inhibiteurs et à un potentiel imposé donné inférieur à −0.60 V, la valeur absolue de la densité du courant cathodique diminue lorsque la concentration en inhibiteur augmente, jusqu'aux concentrations critiques; au delà de ces concentrations critiques, une légère augmentation est observée. Toutefois, l'APDS entraine une réduction plus importante de la valeur absolue de la densité du courant cathodique.
 | ||
| Fig. 6 Courbes de polarisation cathodique et anodique du fer dans HCl 1 M obtenues pour différentes concentrations de (a) l'ATP: (—) 0, (○) 0.05, (×) 0.2, (⋄) 2, (△) 10, (+) 20, (•) 30 mM et de (b) l'APDS: (—) 0, (○) 0.05, (×) 0.2, (⋄) 0.5, (△) 1, (+) 5, (•) 10 mM. | ||
Pour les deux inhibiteurs étudiés, tant que le potentiel anodique appliqué reste inférieur à −0.20 V environ, toute augmentation de la concentration en inhibiteur fait diminuer la densité du courant anodique. Pour des valeurs plus élevées de potentiel (supérieures à −0.15 V environ), les différentes courbes de polarisation ont tendance à converger, aux hautes densités de courant. Cette convergence est souvent expliquée par le fait qu'aux potentiels anodiques élevés, les produits organiques se désorbent et la dissolution du fer a alors lieu sur une surface métallique presque nue.10,15,58 Cette interprétation est d'autant plus plausible que dans ce domaine de potentiel, toutes les courbes de polarisation obtenues en présence d'inhibiteurs se rapprochent de celle obtenue avec l'acide seul.
Les paramètres cinétiques obtenus à partir des courbes de polarisation sont rassemblés dans le Tableau 5. La pente de la droite de Tafel cathodique (bc), relative à la polarisation du fer dans HCl 1 M, est égale à
(−129![[thin space (1/6-em)]](https://www.rsc.org/images/entities/char_2009.gif) ±
±![[thin space (1/6-em)]](https://www.rsc.org/images/entities/char_2009.gif) 5) mV dec−1. Comme il est rapporté dans la littérature,19,58 cette valeur indique, en général, que la réaction de dégagement de dihydrogène sur le fer a lieu suivant le mécanisme de Volmer–Heyrovsky:
5) mV dec−1. Comme il est rapporté dans la littérature,19,58 cette valeur indique, en général, que la réaction de dégagement de dihydrogène sur le fer a lieu suivant le mécanisme de Volmer–Heyrovsky:
En présence d'inhibiteurs, la valeur de bc augmente, mais ceci ne résulte pas nécessairement d'une modification du mécanisme de la réaction.19 En effet, lorsque le taux de recouvrement croît avec la concentration en inhibiteur, l'aire active de l'électrode se trouve réduite et le film adsorbé peut avoir un comportement ohmique, qui se manifeste par une augmentation de la valeur de bc.59 La réaction de dégagement du dihydrogène peut alors suivre le même mécanisme qu'en l'absence d'inhibiteur. Dans ce cas, l'adsorption de l'hydrogène sur la surface du métal est moindre, par suite de l'adsorption des molécules d'inhibiteur. Par conséquent, la réaction d'Heyrovsky se trouve ainsi limitée par la faible quantité des espèces Hads.58
La pente de la droite de Tafel anodique (ba), relative à la polarisation du fer dans HCl 1 M, est de (71![[thin space (1/6-em)]](https://www.rsc.org/images/entities/char_2009.gif) ±
±![[thin space (1/6-em)]](https://www.rsc.org/images/entities/char_2009.gif) 8) mV dec−1. Cette valeur est en accord avec les résultats obtenus dans d'autres études de la corrosion du fer en milieu HCl.60–66 Dans ce cas, Lorenz et al.65 suggèrent un processus de dissolution activée par les ions Cl−, suivant le schéma réactionnel:
8) mV dec−1. Cette valeur est en accord avec les résultats obtenus dans d'autres études de la corrosion du fer en milieu HCl.60–66 Dans ce cas, Lorenz et al.65 suggèrent un processus de dissolution activée par les ions Cl−, suivant le schéma réactionnel:
En présence de chacun des inhibiteurs, les pentes des droites de Tafel anodiques restent comprises entre 63 et 70 mV dec−1. Ainsi, bien que les composés ATP et APDS ralentissent la dissolution du fer, ils ne semblent pas en modifier le mécanisme, cette dissolution se faisant donc essentiellement sur la surface libre du métal.61
La densité de courant de corrosion (icorr) est déterminée par extrapolation de la partie linéaire de la courbe cathodique ou anodique au potentiel de corrosion et l'efficacité inhibitrice ε2 en est déduite. Les résultats obtenus (Tableau 5) montrent que la densité du courant de corrosion du fer dans HCl 1 M est de 132 µA cm−2. Cette valeur est comparable à celles trouvées par d'autres auteurs, dans des conditions similaires.51,67 L'addition de l'ATP ou de l'APDS à la solution électrolytique entraîne une diminution de icorr. Cette diminution est de plus en plus marquée quand la concentration de chacun des deux inhibiteurs augmente jusqu'aux concentrations critiques pour lesquelles on obtient les valeurs 40 et 16 µA cm−2 respectivement pour l'ATP et l'APDS. Par conséquent, l'APDS a une efficacité inhibitrice ε2 égale à 88%, bien meilleure que celle de l'ATP qui n'est que de 70%. On constate alors qu'il y a une bonne concordance avec les valeurs ε1 obtenues par dosage des ions Fe2+ en solution.
Conclusion
L'effet inhibiteur du 2-aminothiophénol (ATP) et du 2-aminophényl-disulfure (APDS) sur la corrosion du fer en milieu HCl 1 M a été quantifié par des mesures analytiques (dosage des ions Fe2+ en solution) ou à l'aide des courbes de polarisation potentiodynamique. Les résultats montrent qu'après une heure d'immersion, l'efficacité de l'APDS est maximale (91%) pour une concentration 10−3 M, alors que l'efficacité maximale de l'ATP nécessite une concentration 10−2 M et ne dépasse pas 73%. L'efficacité de l'inhibiteur s'améliore avec la durée de l'immersion, mais l'écart d'efficacité existant entre les deux composés reste inchangé. Les valeurs négatives de l'enthalpie libre d'adsorption de ces composés et la variation linéaire du taux de recouvrement (θ) avec leur concentration (ln![[thin space (1/6-em)]](https://www.rsc.org/images/entities/char_2009.gif) C) montrent que ces inhibiteurs sont chimisorbés spontanément sur la surface du métal, en suivant une isotherme de Temkin. Les valeurs des pentes des droites de Tafel (bc
C) montrent que ces inhibiteurs sont chimisorbés spontanément sur la surface du métal, en suivant une isotherme de Temkin. Les valeurs des pentes des droites de Tafel (bc![[thin space (1/6-em)]](https://www.rsc.org/images/entities/char_2009.gif) =
=![[thin space (1/6-em)]](https://www.rsc.org/images/entities/char_2009.gif) −129 mV dec−1 et ba
−129 mV dec−1 et ba![[thin space (1/6-em)]](https://www.rsc.org/images/entities/char_2009.gif) =
=![[thin space (1/6-em)]](https://www.rsc.org/images/entities/char_2009.gif) 71 mV dec−1), obtenues à partir des courbes de polarisation, suggèrent que la réaction de dégagement de l'hydrogène sur le fer en milieu HCl 1 M suit le mécanisme de Volmer–Heyrovsky et que la dissolution anodique se fait, d'après Lorenz,65 selon un mècanisme qui suppose une dissolution activée par les ions Cl− avec formation de complexes adsorbés (FeCl−ads, FeH2Oads). En présence
d'inhibiteurs, bc augmente et ba reste presque inchangé. Cependant, les deux réactions peuvent se produire sur la surface libre du métal restant non protégée, avec le même mècanisme que dans HCl seul. Les courants cathodiques (pour E
71 mV dec−1), obtenues à partir des courbes de polarisation, suggèrent que la réaction de dégagement de l'hydrogène sur le fer en milieu HCl 1 M suit le mécanisme de Volmer–Heyrovsky et que la dissolution anodique se fait, d'après Lorenz,65 selon un mècanisme qui suppose une dissolution activée par les ions Cl− avec formation de complexes adsorbés (FeCl−ads, FeH2Oads). En présence
d'inhibiteurs, bc augmente et ba reste presque inchangé. Cependant, les deux réactions peuvent se produire sur la surface libre du métal restant non protégée, avec le même mècanisme que dans HCl seul. Les courants cathodiques (pour E![[thin space (1/6-em)]](https://www.rsc.org/images/entities/char_2009.gif) <
<![[thin space (1/6-em)]](https://www.rsc.org/images/entities/char_2009.gif) −0.60 V/ECS) et anodiques (pour E
−0.60 V/ECS) et anodiques (pour E![[thin space (1/6-em)]](https://www.rsc.org/images/entities/char_2009.gif) <
<![[thin space (1/6-em)]](https://www.rsc.org/images/entities/char_2009.gif) −0.1 V/ECS V), diminuent en présence de l'ATP. Cette diminution est plus importante dans le cas de l'APDS.
−0.1 V/ECS V), diminuent en présence de l'ATP. Cette diminution est plus importante dans le cas de l'APDS.
Pour compléter ce travail, une étude par spectroscopie d'impédance électrochimique sera réalisée. Elle permettra une bonne compréhension du mode d'action de ces deux inhibiteurs.
References
- A. E. Stoyanova, E. I. Sokolova et and S. N. Raicheva, Corros. Sci., 1997, 39, 1595 CrossRef CAS.
- A. A. Aksut et and A. N. Onal, Corros. Sci., 1997, 39, 761 CrossRef.
- T. Yingchu, Z. Quanzhong, G. Zhimang, J. Wenli et and C. Sinong, Wuhan Univ. J. Nat. Sci., 1996, 1, 244 Search PubMed.
- E. Stupnisek-Lisac et Z. Ademovic, Proceedings of the 8th European Symposium on Corrosion Inhibitors, Ann. Univ. Forrara (Italy), N. S. Sez suppl. 5, 1995, vol. 1, p. 257. Search PubMed.
- P. Kutej, J. Vosta, J. Pancir et and N. Hackerman, J. Electrochem. Soc., 1995, 142, 829 CAS.
- B. Szeptycka, Proceedings of the 8th European Symposium on Corrosion Inhibitors, Ann. Univ. Forrara (Italy), N. S. Sez suppl. 5, 1995, vol. 2, p. 737. Search PubMed.
- S. Rengamani, S. Muralidharan, M. Kulandainathan et and S. Veukatakrishna, J. Appl. Electrochem., 1994, 4, 355.
- N. Hajjaji, I. Rico, A. Srhiri, A. Lattes, M. Soufiaoui et and A. Ben Bachir, Corrosion (Houston), 1993, 49, 326 Search PubMed.
- A. Rauscher, G. Kutsan et and Z. Lukas, Corros. Sci., 1993, 35, 1425 CrossRef CAS.
- M. Bartos et and N. Hackerman, J. Electrochem. Soc., 1992, 139, 3428.
- E. Stupnisek-Lisac, M. Metikos-Hokovic, D. Lencic, J. Vorkapic-Furac et and K. Berkovic, Corrosion (Nace), 1992, 48, 924 Search PubMed.
- M. Inara, N. Saito, H. Nishihara et and K. Aramaki, Corros. Sci., 1992, 33, 389 CrossRef.
- A. Frignani, M. Tassinari, L. Mészaros et and G. Trabanelli, Corros. Sci., 1991, 32, 903 CrossRef CAS.
- J. O'M. Bockris et and B. Yang, J. Electrochem. Soc., 1991, 138, 2237.
- N. Saito, H. Nishihara et and K. Aramaki, Corros. Sci., 1991, 32, 577 CrossRef CAS.
- J. O'M. Bockris et and B. Yang, Electrochim. Acta, 1991, 36, 1333 CrossRef.
- A. S. Fouda, S. S. El Kaabi et and A. K. Mohamed, Anti-Corrosion, 1989, 8, 9 Search PubMed.
- K. Aramaki, T. Mochzuki et and H. Nishihara, J. Electrochem. Soc., 1988, 135, 2427 CAS.
- K. C. Pillai et and R. Narayan, Corros. Sci., 1983, 23, 151 CrossRef.
- B. Donnelly, T. C. Downie, R. Grzeskowlak, H. R. Hamburg et and D. Short, Corros. Sci., 1978, 18, 109 CrossRef CAS.
- G. Banerjee et and S. N. Malhotra, Corrosion (Nace), 1992, 48, 10 Search PubMed.
- G. Schmitt et and K. Bedbur, Werkst. Korros., 1985, 36, 273 Search PubMed.
- G. Schmitt, Br. Corros. J., 1984, 19, 165 Search PubMed.
- M. S. Abdel Aal, A. A. Abdel Wahab et and A. El Saied, Corrosion (Nace), 1981, 37, 557 Search PubMed.
- R. L. Leroy, Corrosion (Nace), 1978, 34, 98 Search PubMed.
- J. Vosta, J. Eliasek et and P. Khozek, Corrosion (Nace), 1976, 32, 183 Search PubMed.
- J. Vosta et and J. Eliasek, Corros. Sci., 1971, 11, 223.
- W. J. Lorenz, Z. Phys. Chim., 1970, 65, 244 Search PubMed.
- L. I. Antorpov, Corros. Sci., 1967, 7, 807.
- P. F. Cox, R. L. Every et and O. L. Riggs, Corrosion (Nace), 1964, 20, 299t Search PubMed.
- N. Hackerman, Corrosion (Nace), 1962, 18, 332 Search PubMed.
- L. Olen, J. R. Riggs et and R. L. Every, Corrosion (Nace), 1962, 18, 262 Search PubMed.
- E. Blongren et and J. O'M. Bockris, J. Phys. Chem., 1959, 63, 1475 CrossRef.
- H. Kaescher et and N. Hackerman, J. Electrochem. Soc., 1958, 105, 191.
- G. Schmitt et K. Bedbur, Proceedings of the 9th International Congress on Metallic Corrosion, Toronto, Canada, 1984, vol. 1, p. 112. Search PubMed.
- C. Robert, J. Ayers et and N. Hackerman, J. Electrochem. Soc., 1963, 110, 507.
- M. Duprat, A. Sghiri, Y. Derbali et and N. Pebère, Mater. Sci. Forum, 1986, 8, 267 Search PubMed.
- J. M. Saleh et and Y. K. Al Haidari, Bull. Chem. Soc. Jpn., 1989, 62, 1237.
- P. Markov, C. Roumian et and S. Chorbadjiev, Corros. Sci., 1978, 18, 103 CAS.
- K. Benchekroun, A. Elkhouly et A. Ben-Bachir, Proceedings of the First Arabian Conference On Corrosion Inhibition (Kuwait), Pergamon Press, London, 1984, p. 310. Search PubMed.
- K. Benchekroun, A. Ben-Bachir, A. Sghiri et A. Elkhouly, Proceedings of the International Conference on Corrosion Inhibition (Dallas), 1983. Search PubMed.
- S. Spinelli et and R. S. Gonçalves, Corros. Sci., 1990, 30, 1235 CrossRef.
- A. J. Bard et L. R. Faulkner, Electrochimie: Principes, Méthodes et Applications, Masson, Paris, 1983. Search PubMed.
- A. G. Gadallah, M. M. Hefny, S. A. Salih et and M. S. El-Basiouny, Corrosion (Nace), 1989, 45, 574 Search PubMed.
- I. H. Omar, G. Trabanelli et F. Zucchi, Proceedings of the 10th International Congress on Metallic Corrosion (Madras), 1987, p. 2723. Search PubMed.
- S. T. Arab et and E. A. Noor, Corrosion (Nace), 1993, 49, 122 Search PubMed.
- C. Chu-nan et Z. Shenggi, Proceedings of the 10th International Congress on Metallic Corrosion (Madras), 1987, p. 2777. Search PubMed.
- M. A. Rahim, H. B. Hassan et and M. W. Khalil, Materialwiss. Werkstofftech., 1997, 28, 198 Search PubMed.
- A. Elkanouni, S. Kertit, A. Srhiri et and A. Ben Bachir, Bull. Electrochem., 1996, 12, 517 Search PubMed.
- M. N. Desai et and M. B. Desai, Corros. Sci., 1984, 24, 649 CrossRef.
- G. Perboni et G. Rocchini, Proceedings of the 10th International Congress on Metallic Corrosion (Madras), 1987, p. 193. Search PubMed.
- M. N. Desai, M. B. Desai, C. B. Shah et and S. M. Desai, Corros. Sci., 1986, 26, 827 CrossRef CAS.
- B. Sanyal et and K. Srivastava, Br. Corros. J., 1974, 2, 103 Search PubMed.
- T. Szaner et and A. Brandt, Electrochim. Acta, 1981, 26, 1209 CrossRef.
- T. Szaner et and A. Brandt, Electrochim. Acta, 1981, 26, 1219 CrossRef.
- I. N. Putilova, et S. A. Balezin, U. P. Baran-Nick, Metallic Corrosion Inhibitors, Pergamon Press, New York, 1960, p. 31. Search PubMed.
- O. L. Riggs et and R. M. Hurd, Corrosion (Nace), 1967, 23, 252 Search PubMed.
- E. Laengle et and N. Hackerman, J. Electrochem. Soc., 1971, 118, 1273.
- A. K. Vijh et and B. E. Conway, Chem. Rev., 1967, 67, 623 CrossRef.
- V. Hluchan, B. L. Wheeler et and N. Hackerman, Werkst. Korros., 1988, 39, 512 Search PubMed.
- E. Mc Cafferty et and N. Hackerman, J. Electrochem. Soc., 1972, 119, 146 CrossRef.
- T. A. Oftedal, Electrochim. Acta, 1973, 18, 401 CrossRef CAS.
- Der-Tan-Chin, Proceedings of the 9th International Congress on Metallic Corrosion, Toronto, Canada, 1984, vol. 4, p. 96. Search PubMed.
- S. Sternberg et and V. Brânzoi, Electrochim. Acta, 1984, 29, 15 CrossRef.
- W. J. Lorenz, H. Yamaoka et and H. Fisher, Phys. Chem., 1963, 67, 932 Search PubMed.
- E. McCafferty et and N. Hackerman, J. Electrochem. Soc., 1972, 119, 999.
- L. Meszaros, B. Lengyel, A. Frignani, C. Monticelli et and G. Trabanelli, Mater. Chem. Phys., 1985, 12, 189 CrossRef CAS.
| This journal is © The Royal Society of Chemistry and the Centre National de la Recherche Scientifique 2002 |